EUA(美国应急使用授权)个人防护介绍,现在就让讯科专业的工程师带您了解一下吧!美国食品药品监督管理局(FDA)早在今年(2020年)2月初就为了应对各类医疗器械的紧缺发布了各类EUA(应急使用授权),随后在今年的3月2日及27日又发行了个人防护设备的EUA.
包括:呼吸机EUA、个人防护装备EUA、体外诊断EUA

EUA申请流程
1,递交申请(附相关资料)
2.FDA根据产品类型提交需要注册的资料清单
3企业按要求递交相关资料
4.FDA对其进行审批
5企业根据要求进行整改
6.FDA最终做出决定
其审批时间可能加快至半个月
EUA认可标准和证书
产品面向医用市场
则产品满足以下标准或者认证即可:
澳大利亚ARTG加拿大Health Canada Licence日本PMDA/MHLW
或以下相关标准:
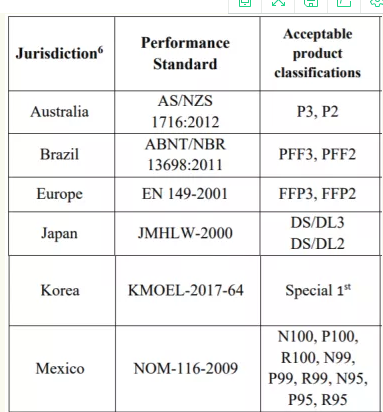
或者直接获得美国NIOSH认证(限以下三种类型)
1)Non-powered air-purifying particulate FFRs and reusable respirators such as elastomeric half and full face piece respirators,approved by NIOSH in accordance with 42 CFR Part 84 and listed on the NIOSH Certified Equipment list(CEL)for non-powered air purifying respirators with particulate protection;
2)Other powered air purifying respirators(PAPRs)approved by NIOSH,in accordance with 42 CFR Part 84,and that are listed on the NIOSH CEL for PAPRS with particulate protection,and;
3)FFRS that were NIOSH-approved but have since passed the manufacturers'recommendec shelf-life,are not damaged,and have been held in accordance with manufacturers'storage conditions in strategic stockpiles,for use in healthcare settings by HCPs.
产品面向个人市场
则产品应获得NIOSH认证
CDC优化呼吸器供应策略中推荐的NIOSH替代标准,除了中国标准:GB 2626-2006外,其他均被EUA采纳。
这就意味着,中国标准不能用于EUA申请。
即使中国标准口置被认为可以提供给个人使用,但目前必须再通过NIOSH认证。
为此我司讯科标准建议;医疗器械欧美上市,产品合规是前提
欧美等国家和地区的上述措施放宽了防控物盗的一些必要准入条件。
但是不难看出这些措施是新冠肺炎疫情紧急情况下采取的应急措施或向成员国提出的应急建议。
且实质并未放松具体技术法规中的技术要求,同时新措施强调了市场抽查和处罚的后市场监管力度。
提前准备产品认证合规准备工作
产品委托检测+技术文件
无论欧美应急措施如何变动,产品合规作为前提的基础上,完成产品相关检测和准备好相关技术文档都是必要的。以上就是讯科标准技术EUA(美国应急使用授权)个人防护装备的介绍
KS作为中国检测和认证服务的创新者,为各行各业的顾客提供专业的检测服务,并不断丰富服务内容,完善服务方式,提高服务质量,成为备受客户信赖的合作伙伴。凭借良好的行业检测技术和先进的检测设备,以及完善的服务网络和卓越的服务理念,我们为客户提供优质检测认证服务,为客户在国际市场上占得先机提供权威的绿色解决方案。深圳讯科技术检测机构从事检测认证行业多年,帮助企业解决更多质量检测报告办理难题,如您有相关办理需求,欢迎您直接来电咨询我司工作人员,获得详细的费用报价与周期等。


